【湘械营四期】《GB/T42061-2022/ISO13485:2016 内审员》培训通知
序言:
2023年11月1日以来GB/T 42061-2022《医疗器械质量管理体系 用于法规的要求》已经实施。为督促医疗器械注册人、备案人落实医疗器械质量安全主体责任,强化医疗器械生产、经营企业质量安全关键岗位人员责任落实,根据《医疗器械监督管理条例》《医疗器械生产监督管理办法》《医疗器械经营监督管理办法》等规定,企业应当按照“权责一致、责任到人,因岗选人、人岗相适,尽职免责、奖惩有据”的原则。
【企业负责人】应当履行组织实施管理评审,定期对质量管理体系运行情况进行评估,并持续改进的工作职责。
【管理者代表】应当是所在企业全职员工,并至少熟悉并能正确执行相关法律、法规、规章、规范和标准,接受过系统化的质量管理体系知识培训。
【管理者代表】在任职后还应当持续加强知识更新,积极参加企业质量管理体系相关学习和培训活动,不断提高质量管理水平。
【关键岗位人员】生产企业、经营企业应当按照质量管理体系要求,对质量安全关键岗位人员进行与其职责和工作内容相关的岗前培训和继续教育,建立培训记录。培训内容应当包括相关法律法规、医疗器械专业知识及技能、质量管理制度等。
为使企业充分理解和落实“标准”和“法律法规”要求,协助质量管理体系顺利升级换版,以适国家飞行检查、监督检查、注册核查、第三方认证和企业自查等,解决企业在实际操作中遇到的问题,我司决定举办《GB/T 42061-2022/ISO 13485:2016 & GB/T 19001-2016/IS0 9001:2015内审员》转版培训课程。现将有关事项通知如下:
一、讲座时间及地点
01 培训方式<<<<
线上线下同时进行培训
02 培训时间<<<<
(一)培训:2023年11月30日-12月1日
(二)报到:参会人员于11月30日上午9:00前至会场签到
02培训地点<<<<
湖南省长沙市浏阳经济技术开发区康平路金阳智中心16栋1层湖南医疗器械实训中心

03联系电话<<<<
彭叶:18873151846
阚丹露:18015016921
二、参会人员
企业负责人、管理者代表、内审员、关键岗位人员等。
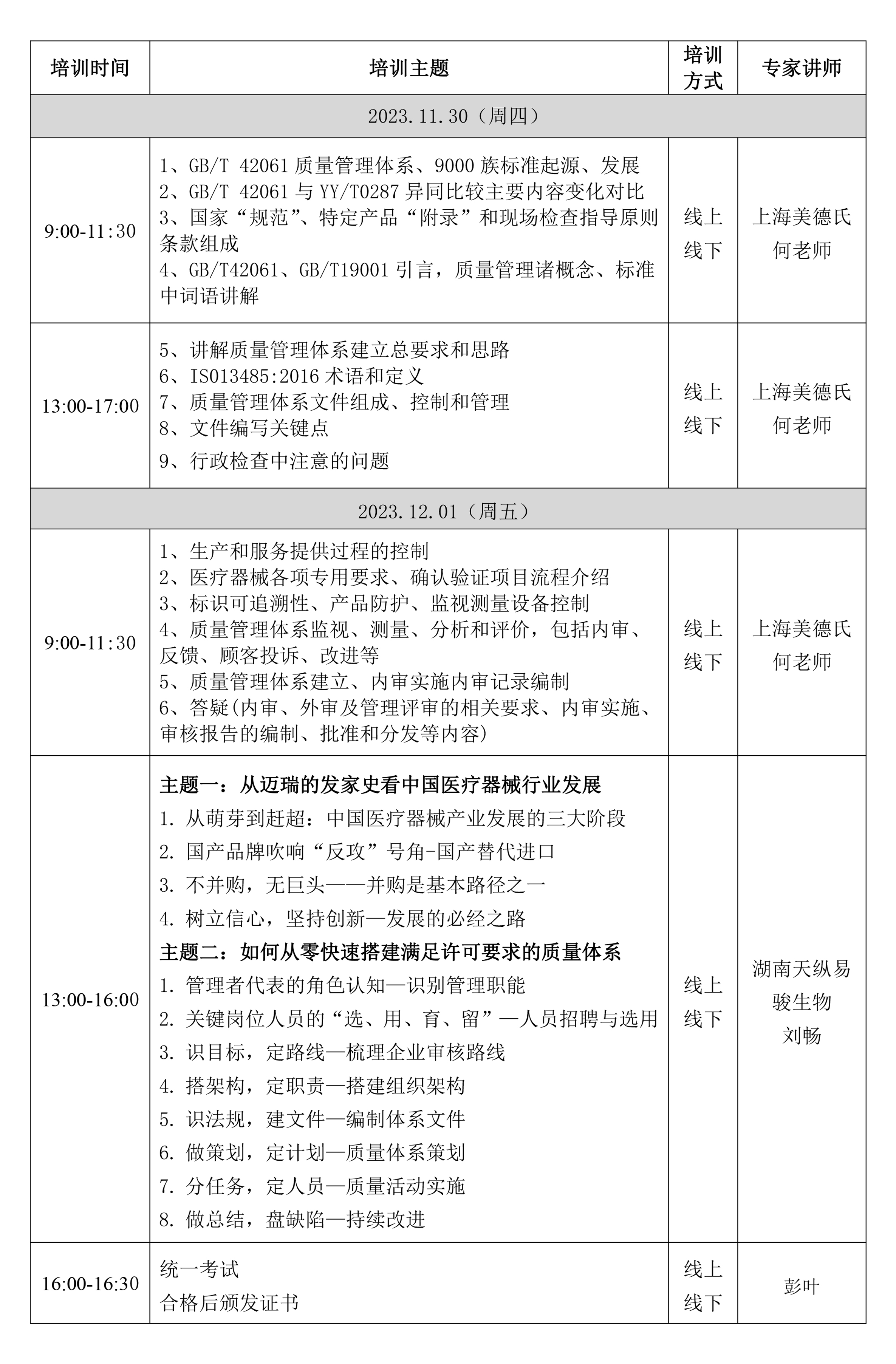
三、培训内容
四、讲师简介
▶ 何老师
◆毕业于浙江科技大学,至今工作35年,主要负责建立和维护ISO13485质量管理体系,并在此基础上针对企业产品的不同销售国,使公司的质量管理体系能符合不同销售国的法规要求,如:欧盟的93/42 EEC MDD认证要求,美国US 21 CFR Part 820要求,加拿大的CMDCAS的要求等。
▶ 刘畅老师
◆生物工程本科,12年生物医药大健康质量领域从业者,先后在生物制药、体外诊断试剂、心血管介入医疗器械企业担任质量全盘管理工作,具备较丰富的质量管理体系搭建、体系审核、产品过程管控、检测实验室管理、产品研发活动、企业合规管理等工作经验。
五、组织单位
主办单位
◆湖南医疗器械GMP实训中心
◆浏阳汇远实业有限公司
◆上海美德氏医疗科技有限公司
◆湖南天纵易骏生物科技有限公司
扫码报名

扫描上方二维码报名参加
《GB/T42061-2022/ISO13485:2016 内审员》
考核通过后领取培训证书
培训费用及缴费方式
培训费用:
感恩回馈:浏阳市智中心、E中心VIP会员单位免费听课并发证(每家企业2名)
换版换证培训及新版内审员费用(含资料和证书):500元/人。
缴费方式:
账户:长沙飞凡科标医学科技有限公司
开 户 行:中国银行股份有限公司浏阳经济技术开发区支行
账号:5976 8051 7483

