【十月会员免费培训】欧盟医疗器械MDR法规及上市后风险评估与风险管理培训通知
序言
欧盟医疗器械新法规 MDR (EU2017/745)已于2021年5月26日强制执行,新法规融合了原先的MDD指令和 AIMD°指令,在各方职责、产品分类、符合性评估途径、临床数据等方面都有重大变化,对进入欧洲市场的医疗器械实行更严格的限制,也给中国出口企业带来了极大挑战。飞凡医药将全面协助企业解决法规相关问题,携手与制造商及公告机构共进退!现特邀各单位积极选派人员参加。为协助医疗器械企业熟悉MDR法规指令,快速、准确获取CE认证,调整产品上市策略,尽快精准进行商业布局,现举办“欧盟MDR重要板块及临床监管与风险”。
一、时间、地点、单位
01 培训时间<<<<
2023年10月28日(线上线下同时进行)
报到:参会人员于10月28日上午8:30前至会场签到。
02培训地点<<<<
常州市武进区湖塘科技产业园B2栋二楼多功能会议室
03活动单位<<<<
主办单位:常州飞凡医药信息咨询服务有限公司
协办单位:苏州科睿医疗科技有限公司
洲通健康科技(上海)有限公司
医疗器械注册人、备案人<<<<
管代、法规、注册及研发人员
三、课程内容
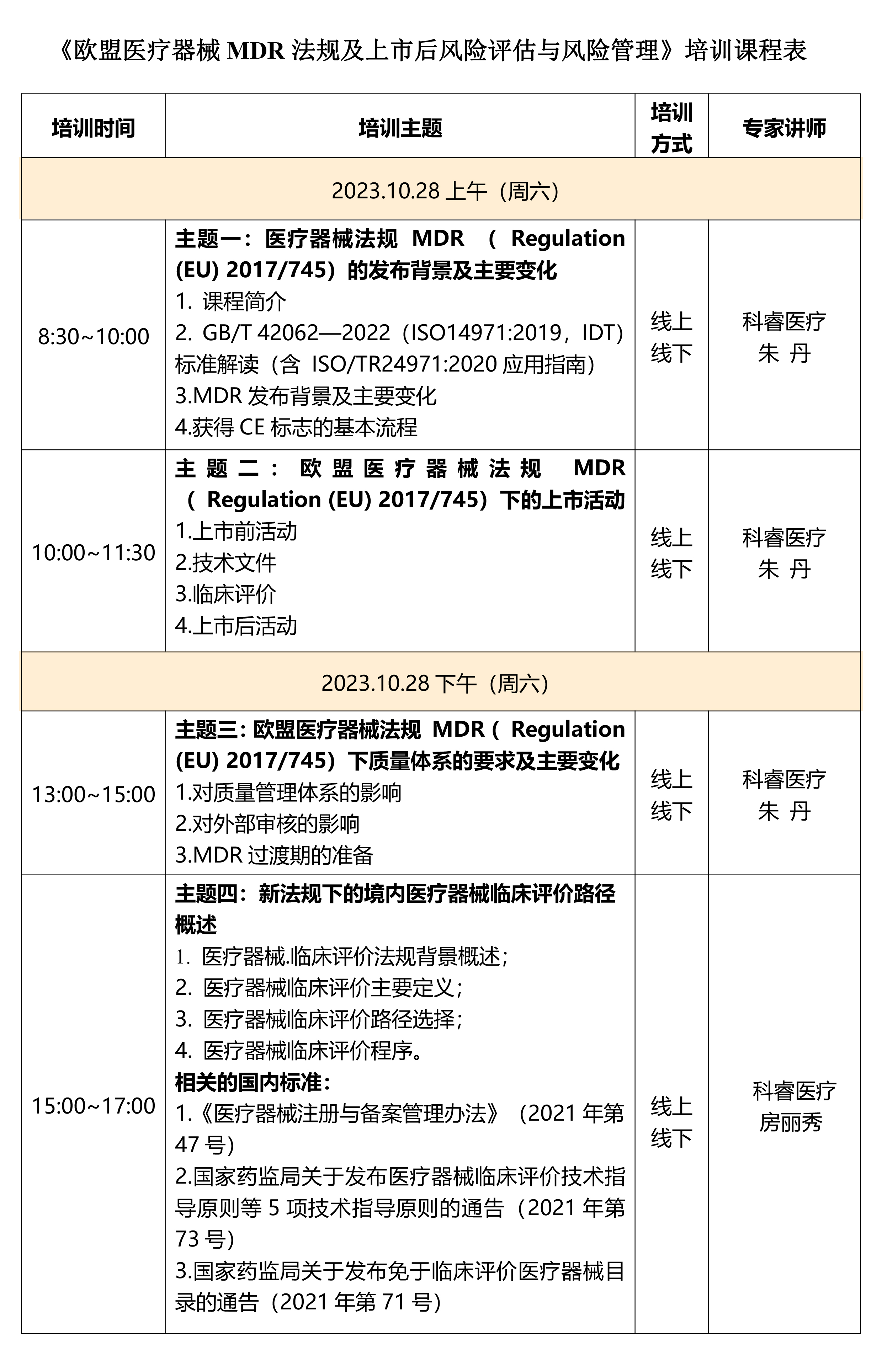
四、主讲专家
朱丹
▶洲通健康 副总经理/苏州医疗器械行业协会专家库首批成员
20年医疗器械制造业及公告机构工作经验。
2002年加入医疗器械行业,负责产品研发、质量体系和法规管理等工作。
2006年加德国莱茵TUV医疗器械部,历任项目经理、无源审核组组长和副总经理等职。作为德国莱茵TUV授权的主任审核员,实施MDD、IVDD、ISO13485MDSAP、ISO13485 under_CMDCAS、Or-dinance169uder、PAL等审核工作,完成近千个审核项目。
房丽秀
▶科睿医疗临床评价部副总监
15余年医疗器械行业经验,7年医疗器械临床试验项目经验,曾在苏州某上市医疗器械公司任医学职务,负责大外科、血管外科产品的临床试验。
项目涉及领域:普外科、血管外科等;参与多项三类高风险医疗器械临床试验方案设计。参与等离子手术系统、红蓝光治疗仪、闭合夹、腔镜吻合器的境内临床评价。
扫码报名

扫描上方二维码联系老师参与报名培训
考核通过后领取培训证书
培训费用及缴费方式
培训费用:
VIP会员单位:免费参加,每家企业限两人。
非VIP会员单位:900元/人。
缴费方式:
账户:常州飞凡医药信息咨询服务有限公司
开 户 行:中国银行股份有限公司常州湖塘支行
账号:5222 5977 2281

